Un medicamento es una sustancia con propiedades para el tratamiento o la prevención de enfermedades en los seres humanos. También se consideran medicamentos aquellas substancias que se utilizan o se administran con el objetivo de restaurar, corregir o modificar funciones fisiológicas del organismo o aquellas para establecer un diagnóstico médico. Los medicamentos se emplean a dosis tan pequeñas, que para poder administrar la dosis exacta, se deben preparar de forma que sean manejables. Las diferentes maneras en qué se preparan (pastillas, jarabes, supositorios, inyectables, pomadas, etc.) se denominan formas farmacéuticas. Los medicamentos no sólo están formados por substancias medicinales, a menudo van acompañados de otras substancias que no tienen actividad terapéutica, pero que tienen un papel relevante. Estas substancias son las que permiten que el medicamento tenga estabilidad y se conserve adecuadamente. Estas sustancias sin actividad terapéutica tienen un papel muy importante en la elaboración, almacenamiento y liberación de substancias medicinales se denominan excipientes. Algunos de ellos son de declaración obligatoria, mientras que las substancias medicinales, que son las que tienen actividad terapéutica, se denominan principios activos.
¿Qué es un principio activo?
Los principios activos son la sustancia a la cual se debe el efecto farmacológico de un medicamento, y su uso se remonta a la prehistoria, en un principio eran hierbas y sustancias naturales, luego en los últimos siglos se fue ron aislando sus componentes de las plantas, y en el siglo XX se logró identificar la estructura de muchas de ellas. La actividad de un principio activo varía debido a la naturaleza de estos, pero siempre está relacionado a la cantidad ingerida o absorbida
Esta sustancia con actividad farmacológica extraída de un organismo vivo. Una vez purificada y/o modificada químicamente, se le denomina fármaco.
Nomenclatura
El nombre que se da a un principio activo no tiene necesariamente relación con su estructura química, también dos principios activos pueden tener nombres muy similares y ser de uso completamente diferentes, por lo que para su estudio se debe conocer la estructura química, ya que muchos compuestos de estructura similar tienen efectos farmacológicos similares, y efectos secundarios similares.
Un medicamento puede tener como principio activo elementos puros, compuestos
Inorgánicos, o compuestos orgánicos como los siguientes:
• Un elemento natural (de la tabla periódica), como ser el magnesio,
• Un compuesto inorgánico (una molécula formada por varios átomos) inorgánico como: Un oxido metálico: Oxido de Zinc, Oxido de Hierro. Un óxido ácido, Puede ser un hidróxido: Como el hidróxido de aluminio Al(OH)3. Puede ser un ácido, Una sal: Como el cloruro de sodio (NaCl) o sal de mesa, El Bicarbonato de sodio o Na(CO)3, Carbonato de litio.
Aunque en su mayoría son compuestos orgánicos:
• Un alcaloide: Como la vincristina, la vinblastina, etc.
• Un carbohidrato: Oligosacáridos (Glicerina, Sacarosa, glucosa, maltosa), Polisacáridos:
Celulosa, almidón, etc.
• Un Hidrocarburo: Compuestos alifáticos, ácido carboxílico (Acido acético), esteres, éteres
(Como las perlas de éter), aromáticos (como el fenol).
¿que es un excipìente?
son sustancias sin actividad terapéutica tienen un papel muy importante en la elaboración, almacenamiento y liberación de substancias medicinales
composicion de medicametos
son sustancias sin actividad terapéutica tienen un papel muy importante en la elaboración, almacenamiento y liberación de substancias medicinales
composicion de medicametos
1- El paracetamol (DCI) o acetaminofén es un fármaco con propiedades analgésicas, sin propiedades antiinflamatorias clínicamente significativas. Actúa inhibiendo la síntesis de prostaglandinas, mediadores celulares responsables de la aparición del dolor. Además, tiene efectos antipiréticos. Se presenta habitualmente en forma de cápsulas, comprimidos, supositorios o gotas de administración oral.
Los nombres paracetamol y acetaminofén pertenecen a la historia de este compuesto y provienen de la nomenclatura tradicional de la química orgánica, N-acetil-para-aminofenol y para-acetil-aminofenol.Según las recomendaciones de 1993 de la IUPAC, el nombre de este compuesto es N-(4-hidroxifenil) etanamida.
2- El diclofenaco (también conocido como diclofenac) es un medicamento inhibidor relativamente no selectivo de la ciclooxigenasa y miembro de la familia de los antiinflamatorios no esteroideos (AINEs) indicado para reducir inflamaciones y como analgésico, pues reduce dolores causados por heridas menores y dolores tan intensos como los de la artritis. También se puede usar para reducir los cólicos menstruales.
Diclofenaco es un derivado fenilacético,[1] cuyo nombre químico es ácido 2-[2-[(2,6-diclorofenil) amino]fenil]acético y cuya fórmula química es C14H11Cl2NO2.
formula: cada gragea contiene:
diclofenaco sodico: 100 mg
exipiente cbp 1 gragea
3- Ketorolaco
formula:
cada tableta contiene: ketorolaco
trometamina 10 mg
excipiente cbp 1 tableta
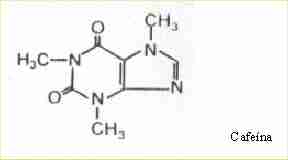
4- ergotamina y cafeina
formula: cada comprimido contiene:
tartrato de ergotamina: 1 mg
cafeina: 100 mg
excipiente cbp 1 comprimido
5- albendazol
formula:
cada tableta contiene:
albendazol 200 mg
excipiente cbp 1 tableta